空格2024年6月18日海洋生物多样性与进化研究所海洋资源生物学团队联合青岛海洋生物医药研究院杨金波教授课题组在药物化学顶尖期刊Journal of Medicinal Chemistry 发表研究成果“Structural Optimization of Marine Natural Product Pretrichodermamide B for the Treatment of Colon Cancer by Targeting the JAK/STAT3 Signaling Pathway”。该论文采用封闭代谢位点及骨架重排等结构优化策略,设计合成了体内外活性优异、成药性高的抗肿瘤海洋药物先导物Tri B,并揭示了其靶向性抑制STAT3磷酸化,阻断JAK/STAT3信号通路的抗肿瘤作用机制。
空格信号转导-转录激活因子3(转录因子STAT3)在细胞增殖与凋亡平衡过程中起到重要调节作用,参与JAK/STAT3等众多致癌信号通路,是极具潜力的抗肿瘤新途径。目前,处于发现阶段的STAT3小分子抑制剂结构较为单一、活性不足等问题,尚无获批上市药物。
空格海洋微生物活性次级代谢产物结构新颖、药理活性广泛,是药物先导化合物的重要来源。团队前期从深海微紫青霉Penicillium janthinellum SH0301中分离获得可靶向STAT3的环硫二酮哌嗪Pre B,其对多种肿瘤细胞具有低微摩尔级增殖抑制活性(赵晨阳教授团队合作,Mar. Life Sci. Technol., 2023, 5, 94-101)。但代谢稳定性差(在小鼠血浆中的半衰期小于5 min)影响了其体内药效的发挥。
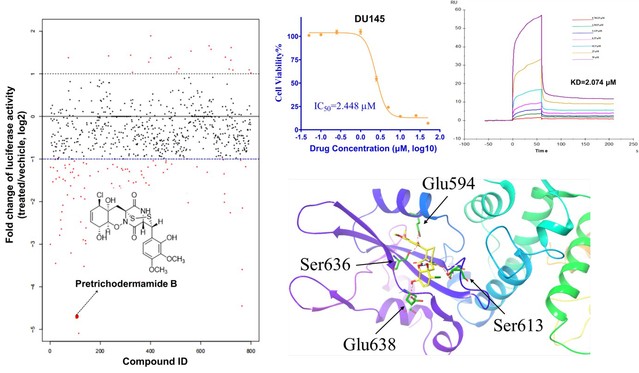
图1. 靶向STAT3的小分子Pre B的发现
空格为了提高代谢稳定性,团队采用封闭代谢位点及骨架重排等基于配体结构的药物设计方法,设计合成了一系列Pre B衍生物。其中,通过骨架重排获得的海洋天然产物Tri B对结肠癌细胞HCT116的抑制IC50为120 nM。同时,Tri B显示出更好的代谢稳定性(小鼠血浆中的半衰期为31 min)及口服生物利用度(F = 37.5%)。WB结果显示Tri B以剂量和时间依赖的方式阻断了JAK/STAT3信号通路,给药1 h即可迅速抑制STAT3磷酸化水平;在HCT116异种移植瘤裸小鼠模型中,Tri B在20 mg/kg的剂量下显著抑制肿瘤生长(TGI = 65%),是值得进一步开发的抗结肠癌海洋药物先导化合物。
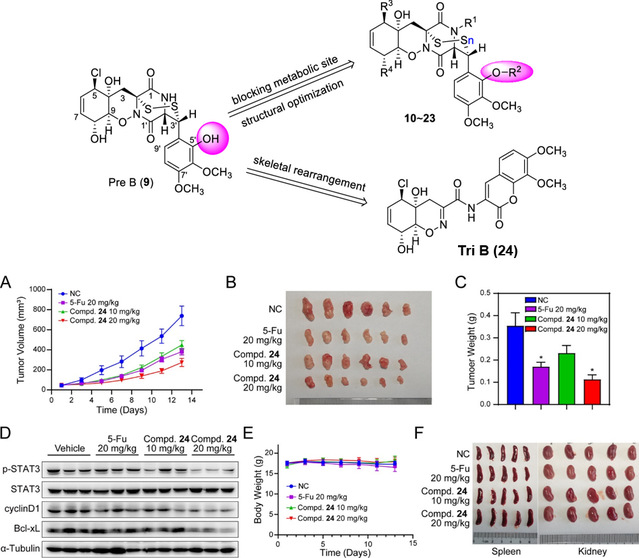
图2. 基于代谢稳定性的结构优化获得先导物Tri B
空格中国海洋大学为第一通讯单位,刘志清教授、杨金波教授和王长云教授为共同通讯作者,医药学院博士研究生周月和硕士研究生贺娜为文章第一作者。该工作得到国家自然科学基金、中央高校基本科研业务费、上海市药物靶标发现及递送前沿科学研究基地、山东省泰山学者青年专家项目的资助。
文章链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c00278


