DNA N6-腺嘌呤甲基化(6mA)是原核生物中一种广泛存在的 DNA 修饰,近年来在真核生物中也陆续被鉴定和发现,并成为表观遗传学领域的研究热点。在人、小鼠、线虫、拟南芥及单细胞的四膜虫、衣藻和早期分化的真菌中,调控 6mA 的甲基化酶或去甲基化酶已被系统鉴定和研究[1-7],但有关 6mA 在真核生物中的功能和调控机理的探索才刚刚起步。
进化所高珊教授团队主要以单细胞真核模式生物四膜虫为研究材料,解析了 6mA 的分布模式、甲基转移酶及其在细胞生长发育中的功能和调控通路。相关研究分别于 2017、2019 年两次发表在国际著名学术期刊Nucleic Acids Research上。然而,6mA 在 DNA 复制时期的遗传机制尚不可知,影响了对其调控机制和生物学意义的解读。

为了进一步研究真核生物 6mA 是否可以进行稳定的遗传,该团队与南加州大学刘一凡副教授合作,首次从单分子的层面证实了真核生物 6mA 的遗传方式(半保留遗传),并发现了课题组之前报道的 6mA 甲基化酶 AMT1 是参与此过程的维持性甲基化酶。研究成果以“Semiconservative transmission of DNA N6-adenine methylation in a unicellular eukaryote”为题,发表在著名学术期刊 Genome Research 上。
该工作利用单分子实时环状一致测序技术(SMRT CCS)(图1A),鉴别出了基因组中不同甲基化状态的 6mA 位点(全甲基化Full、半甲基化Hemi、未甲基化Un)(图1B)。研究发现,野生型细胞中 6mA 主要以全甲基化状态分布在互补的 ApT双核苷酸序列上(图1B),半甲基化 6mA 位点在同步化细胞的 DNA 复制期(S期)明显增多。进一步通过 BrdU 对 S 期新合成的子链进行标记,发现半甲基化 6mA 与 BrdU 呈明显的互斥性分布,表明 6mA 存在于复制后的亲本链上(图1C-D)。上述结果表明 6mA 以经典的半保留方式进行遗传。
研究还发现,在 6mA 甲基化酶 AMT1 敲除株系中,全甲基化几乎消失而半甲基化 6mA 的比例则大幅度升高,表明AMT1 对半甲基化到全甲基化的转变至关重要(图1B)。体外酶活实验同时表明,AMT1 复合物主要靶向 ApT 二核苷酸序列,且偏好性地将半甲基化催化为全甲基化,进一步支持了 AMT1 是 6mA 的维持性甲基化酶(图1E-F)。
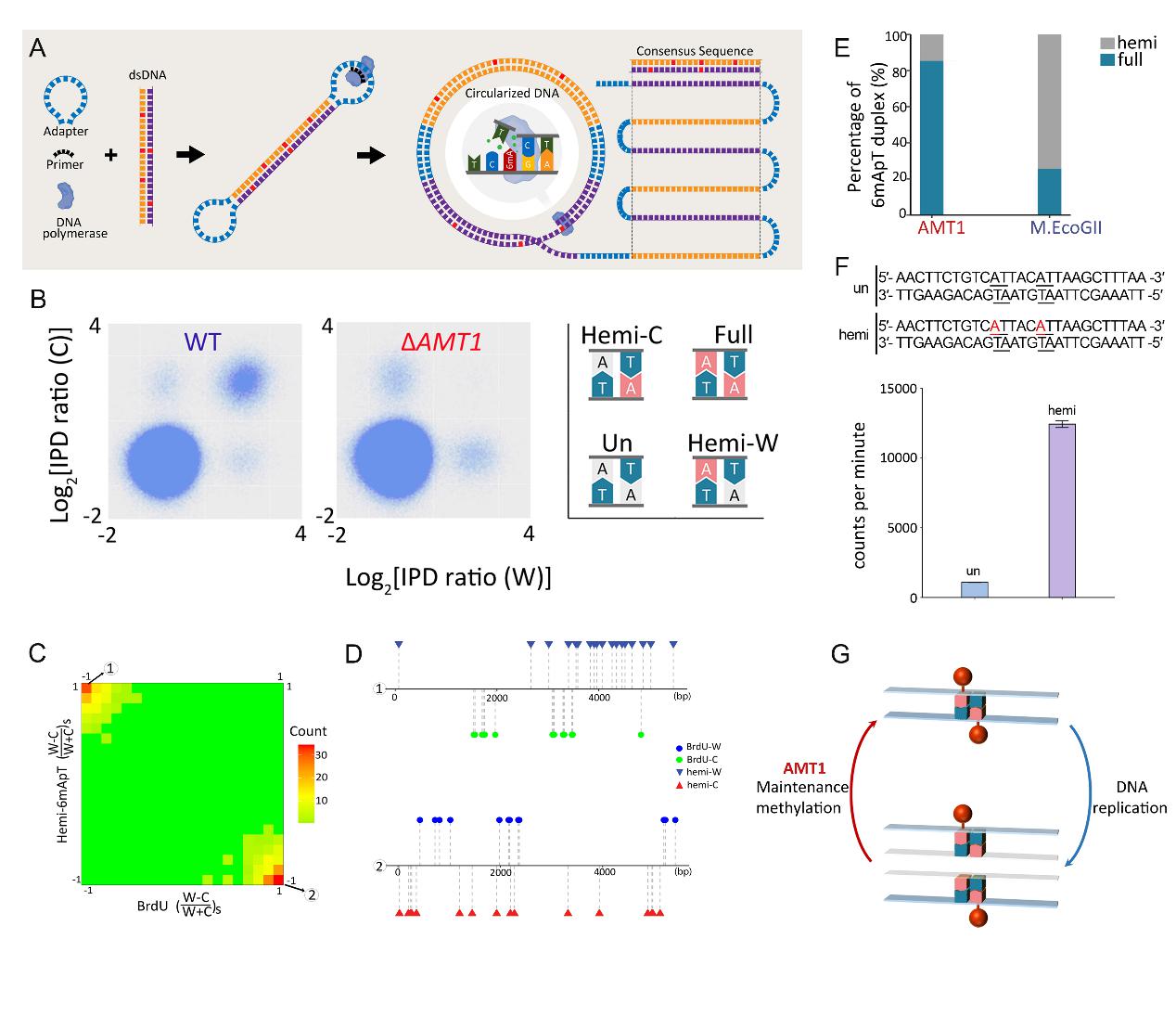
图1. 6mA以半保留的方式进行遗传。(A)SMRT-CCS测序原理示意图。(B)AMT1 敲除后全甲基化(Full)位点消失。(C)半甲基化的 6mA(Hemi-6mA)位点与 BrdU 标记的新生链互补分布,表明 Hemi-6mA 分布在母本链上。(D)半甲基化的6mA(Hemi-6mA)位点与BrdU标记的新生链互补分布代表性位点示意图。(E)AMT1 倾向于将位点催化成全甲基化状态。(F)体外酶活实验显示 AMT1 对半甲基化底物有明显的偏好性。(G)6mA 半保留遗传的模式图。
该工作揭示了真核生物 6mA 以半保留方式进行遗传的机制(图1G),并发现了该课题组之前报道的 6mA 甲基化酶 AMT1 是参与此过程的维持性甲基化酶。这项研究不仅解析了依赖于 AMT1 的维持甲基化和独立于 AMT1 的从头甲基化过程,还揭示了一条与5-甲基胞嘧啶(5mC)在 CpG 二核苷酸上传递相似的 6mA 传递路径。对 6mA 遗传机制的解析和 6mA 甲基化酶在该过程中的调控机制的研究,为确认真核生物 6mA 是一种真正的表观遗传标记提供了关键证据(图2)。
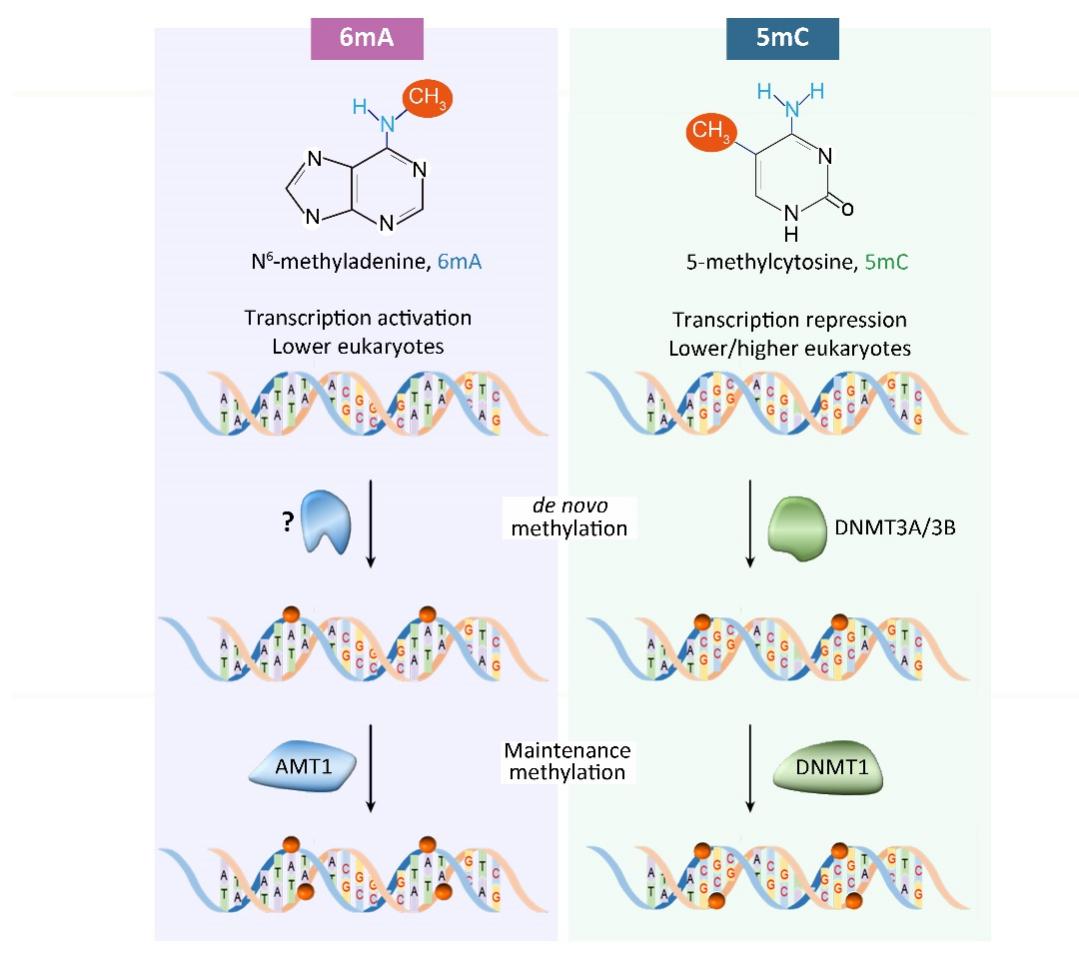
图2.真核生物两种 DNA 甲基化(6mA vs. 5mC)调控通路比较。
该研究由南加州大学刘一凡课题组与进化所高珊课题组共同完成。高珊课题组博士毕业生盛亚岚和副教授王媛媛、刘一凡课题组博士后杨文涛为该文章的共同第一作者。高珊教授和南加州大学的刘一凡副教授为文章的通讯作者。加州大学河滨分校宋吉奎教授和博士后陆久维,南加州大学窦亚丽教授、李春教授和博士后王雪晴,高珊课题组博士毕业生潘博、博士生南北、博士后刘永强和博士生叶飞对本文亦有重要贡献。

团队合影(左5为高珊教授,左7为刘一凡副教授)
原文链接:
http://www.genome.org/cgi/doi/10.1101/gr.277843.123
参考文献
[1]Fu Y, Luo GZ, Chen K, Deng X, Yu M, Han D, Hao Z, Liu J, Lu X, Doré LC. N6-methyldeoxyadenosine marks active transcription start sites in Chlamydomonas. Cell. 2015, 161(4):879-92.
[2]Greer EL, Blanco MA, Gu L, Sendinc E, Liu J, Aristizábal-Corrales D, Hsu CH, Aravind L, He C, Shi Y. DNA methylation on N6-adenine in C. elegans. Cell. 2015, 161(4):868-78.
[3]Zhang G, Huang H, Liu D, Cheng Y, Liu X, Zhang W, Yin R, Zhang D, Zhang P, Liu J. N6-methyladenine DNA modification in Drosophila. Cell. 2015, 161(4):893-906.
[4]Mondo SJ, Dannebaum RO, Kuo RC, Louie KB, Bewick AJ, LaButti K, Haridas S, Kuo A, Salamov A, Ahrendt SR. Widespread adenine N6-methylation of active genes in fungi. Nat Genet. 2017, 49(6):964-8.
[5]Seidl MF. Adenine N6-methylation in diverse fungi. Nat Genet. 2017, 49(6):823-4.
[6]Wang Y, Chen X, Sheng Y, Liu Y, Gao S. N6-adenine DNA methylation is associated with the linker DNA of H2A.Z-containing well-positioned nucleosomes in Pol II-transcribed genes in Tetrahymena. Nucleic Acids Res. 2017, 45:11594-606.
[7]Wang Y, Sheng Y, Liu Y, Zhang W, Cheng T, Duan L, Pan B, Qiao Y, Liu Y, Gao S. A distinct class of eukaryotic MT-A70 methyltransferases maintain symmetric DNA N6-adenine methylation at the ApT dinucleotides as an epigenetic mark associated with transcription. Nucleic Acids Res. 2019, 47(22):11771-89.


